公司: 辉瑞公司
批准日期: 2022 年 1 月 14 日
治疗:特应性皮炎
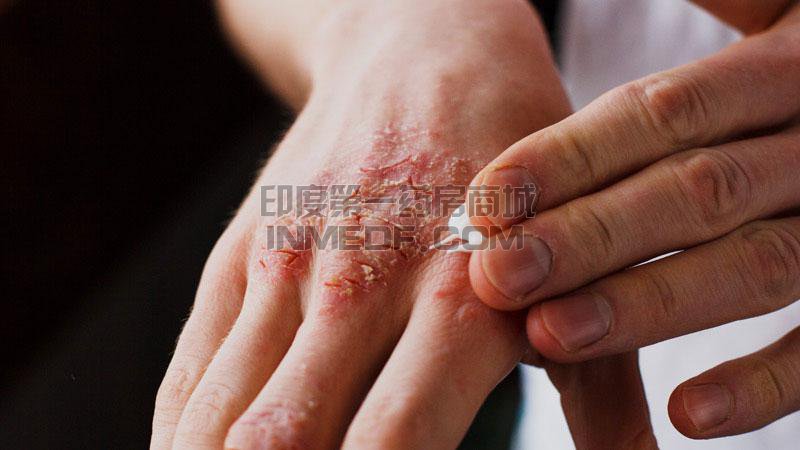
Cibinqo (abrocitinib) 是一种 Janus 激酶 (JAK) 1 抑制剂,用于治疗成人难治性中度至重度特应性皮炎 (AD)。
美国 (US) 食品药品监督管理局 (FDA) 批准了 Cibinqo (abrocitinib),这是一种口服、每日一次的药物, Janus 激酶 1 (JAK1) 抑制剂,用于治疗患有顽固性、中度至重度特应性皮炎 (AD) 的成人,其疾病无法通过其他全身性药物产品(包括生物制剂)得到充分控制,或者当使用这些疗法时不宜。
Cibinqo 被批准的推荐剂量为 100 毫克和 200 毫克,对于对 100 毫克剂量没有反应的患者,建议使用 200 毫克剂量。此外,50 mg 剂量被批准用于治疗中度至重度 AD,特别是在中度肾功能不全(肾衰竭)患者、某些接受细胞色素 P450 (CYP) 2C19 抑制剂治疗的患者,或已知或疑似是 CYP2C19 的弱代谢者。对于中度肾功能不全的患者,对每天一次 50 毫克没有反应的患者,也可以开出每天一次 100 毫克的处方。
“对于患有慢性炎症性
皮肤病(例如中度至重度特应性皮炎)的患者来说,现实情况是,许多人会出现目前治疗方案无法控制的衰弱症状。今天对 Cibinqo 的批准将提供一个重要的新口服选择,可以帮助那些尚未找到缓解的人,”乔治华盛顿大学医学与健康科学学院
皮肤病学系医学博士、博士、公共卫生硕士 Jonathan Silverberg 说。“在多项大规模临床试验中,Cibinqo 在清洁皮肤、改善瘙痒以及控制湿疹的程度和严重程度方面表现出强大的功效,提供了支持在 FDA 批准的患者群体中使用这种治疗方法的效益风险概况。 ”
FDA 的批准是基于 1,600 多名患者的大规模临床试验计划的五项临床试验的结果。Cibinqo 的安全性和有效性在三项随机、安慰剂对照的 3 期试验中进行了评估。此外,安全性通过一项随机、安慰剂对照、剂量范围试验和一项正在进行的长期开放标签扩展试验进行了评估。在整个试验中,对于一些患有 AD 的人与安慰剂相比,Cibinqo 证明了一致的安全性和皮肤清除、疾病程度和严重程度的显着改善,以及两周后瘙痒的快速改善。此外,与安慰剂相比,在两项单一疗法试验中,接受 Cibinqo 治疗的受试者在第 12 周时瘙痒改善的比例更高。
“美国食品和药物管理局的批准为每天遭受免疫炎症疾病折磨的美国数百万患者带来了希望,如果不加以控制,可能会导致强烈和持续的瘙痒、疼痛、不适和痛苦,”全球总裁 Mike Gladstone 说。辉瑞炎症与免疫学。“Cibinqo 是一种有效的每日一次的药丸,是辉瑞研究人员和参与我们临床试验的中度至重度特应性皮炎患者实现的医学突破。”
“特应性皮炎不仅仅是皮疹,它超越了皮肤表面。这是一种慢性病,会严重扰乱患者的日常生活,并对他们的情绪健康产生负面影响,”全国湿疹协会主席兼首席执行官 Julie Block 说。“我们感谢辉瑞对这个富有弹性的患者社区的承诺,并热切期待 Cibinqo 可能对中度至重度特应性皮炎的治疗前景产生积极影响。”
≥5% Cibinqo 患者报告的最常见不良事件包括鼻咽炎(12.4% Cibinqo 100 mg、8.7% Cibinqo 200 mg 和 7.9% 安慰剂)、恶心(6%、14.5% 和 2.1% ,分别)和头痛(分别为 6%、7.8% 和 3.5%)。
Cibinqo 临床试验计划的其他详细信息
Cibinqo JAK1特应性皮炎疗效和安全性(JADE)全球开发计划中的五项临床试验被纳入新药申请(NDA),以支持FDA批准。
Cibinqo 的安全性和有效性在三个 3 期、随机、安慰剂对照临床试验中进行了评估。这些试验评估了皮肤清除、瘙痒、疾病程度和严重程度的改善措施,包括调查员全球评估 (IGA)、湿疹面积和严重程度指数 (EASI) 和峰值瘙痒数值评定量表 (PP-NRS)。在每项试验中,超过 40% 的患者曾接受过全身治疗:
JADE MONO-1 和 JADE MONO-2:一对随机、双盲、安慰剂对照试验,旨在评估 Cibinqo 单药两种剂量(100 毫克和 200 毫克每天一次)在 778 名患者中 12 年的疗效和安全性年龄及以上的中度至重度 AD。这些试验在第 12 周评估了 IGA 和 EASI-75 反应的共同主要终点。
JADE COMPARE:一项随机、双盲、安慰剂对照试验,旨在评估两种剂量(100 mg 和 200 mg 每天一次)的 Cibinqo 在 837 名背景局部用药的中度至重度 AD 成人患者中的疗效和安全性治疗。与安慰剂相比,该试验还包括一个带有 dupilumab 的主动控制组,dupilumab 是一种通过皮下注射进行的生物治疗。该试验在第 12 周评估了 IGA 和 EASI-75 反应的共同主要终点。
Cibinqo 100 mg、200 mg 和安慰剂的选择结果如下(*p<0.01 或 **p<0.001):
玉单声道-1:
IGA 响应率(第 12 周):分别为 24%*、44%** 和 8%
EASI-75 响应率(第 12 周):分别为 40%**、62%** 和 12%
JADE MONO-2
IGA 响应率(第 12 周):分别为 28%**、38%** 和 9%
EASI-75 响应率(第 12 周):分别为 44%**、61%** 和 10%
玉石比较
IGA 响应率(第 12 周):分别为 36%**、47%** 和 14%
EASI-75 响应率(第 12 周):分别为 58%**、68%** 和 27%
安全性还通过一项随机剂量范围试验和一项长期、开放标签、扩展试验(JADE EXTEND)进行了评估。
美国重要安全信息
警告:严重感染、死亡率、恶性
肿瘤、主要不良心血管事件和血栓形成
严重感染
接受 Cibinqo 治疗的患者发生严重感染的风险可能会增加,从而导致住院或死亡。Cibinqo 最常见的严重感染是单纯疱疹、带状疱疹和肺炎。
如果发生严重或机会性感染,请停止 Cibinqo 并控制感染。
用于治疗炎症的 Janus 激酶 (JAK) 抑制剂报告的感染:
活动性肺结核,可能表现为肺部或肺外疾病。在治疗前和治疗期间检测潜伏性结核病;使用前治疗潜伏性结核病。在治疗期间监测所有患者的活动性结核病,即使是最初阴性、潜伏性结核病检测的患者。
侵袭性真菌感染,包括隐球菌病和肺孢子虫病。侵袭性真菌感染患者可能会出现播散性而非局部性疾病。
由机会性病原体引起的细菌、病毒(包括带状疱疹)和其他感染。
避免在患有活动性严重感染(包括局部感染)的患者中使用 Cibinqo。在开始治疗慢性或复发性感染患者或在地方性结核病或地方性真菌病地区居住或旅行的患者之前,应仔细考虑使用 Cibinqo 治疗的风险和益处。
在使用 Cibinqo 治疗期间和之后,应密切监测患者感染体征和症状的发展,包括在开始治疗前潜伏性结核感染检测呈阴性的患者可能发展为结核病。
考虑每年对结核病高度流行地区的患者进行筛查。Cibinqo 不推荐用于活动性结核病患者。对于新诊断为潜伏性结核病或既往未治疗的潜伏性结核病患者,或潜伏性结核病检测阴性但感染结核病风险高的患者,在开始使用 Cibinqo 之前开始对潜伏性结核病进行预防性治疗。
Cibinqo 的临床研究报告了病毒再激活,包括疱疹病毒再激活(例如,带状疱疹、单纯疱疹)。如果患者出现带状疱疹,请考虑中断 Cibinqo 直到发作消退。在接受 JAK 抑制剂的患者中报告了乙型肝炎病毒再激活。在开始治疗前和使用 Cibinqo 治疗期间,根据临床指南进行病毒性肝炎筛查和再激活监测。Cibinqo 不推荐用于活动性乙型肝炎或丙型肝炎患者。
死亡
在一项针对 50 岁及以上具有至少一个心血管危险因素的类风湿关节炎 (RA) 患者的大型随机上市后安全性研究中,比较另一种 JAK 抑制剂与 TNF 阻滞剂治疗,全因死亡率(包括心血管猝死) ) 用 JAK 抑制剂观察到。Cibinqo 未被批准用于 RA 患者。
在接受 Cibinqo 治疗的患者中报告了恶性肿瘤,包括非
黑色素瘤皮肤癌 (NMSC)。在接受用于治疗炎症的 JAK 抑制剂的患者中观察到
淋巴瘤和其他恶性肿瘤。对皮肤癌风险增加的患者进行定期皮肤检查。应通过穿防护服和使用广谱防晒霜来限制暴露在阳光和紫外线下。
在一项针对 RA 患者的另一种 JAK 抑制剂的大型随机上市后安全性研究中,与接受 TNF 阻滞剂治疗的患者相比,接受 JAK 抑制剂治疗的患者的恶性肿瘤(不包括非
黑色素瘤皮肤癌 [NMSC])的发生率更高。Cibinqo 未被批准用于 RA 患者。与接受 TNF 阻滞剂治疗的患者相比,接受 JAK 抑制剂治疗的患者的
淋巴瘤发病率更高。与接受 TNF 阻滞剂治疗的吸烟者相比,接受 JAK 抑制剂治疗的当前或过去吸烟者的
肺癌发病率更高。目前或过去吸烟的患者面临额外增加的风险。
在开始或继续使用 Cibinqo 治疗之前考虑个体患者的益处和风险,特别是对于已知恶性肿瘤(成功治疗的 NMSC 除外)的患者、在治疗时发生恶性肿瘤的患者以及当前或过去的患者吸烟者。
主要心血管不良事件
在接受 Cibinqo 治疗的患者中报告了主要不良心血管事件。在 50 岁及以上且至少有一个心血管危险因素且使用另一种 JAK 抑制剂治疗的 RA 患者中,观察到较高的主要不良心血管事件 (MACE)(定义为心血管死亡、心肌梗塞和中风)发生率与 TNF 阻滞剂。Cibinqo 未被批准用于 RA 患者。目前或过去吸烟的患者面临额外增加的风险。在经历过心肌梗塞或中风的患者中停用 Cibinqo。
在开始或继续使用 Cibinqo 治疗之前,请考虑个体患者的益处和风险,特别是对于当前或过去吸烟的患者以及具有其他心血管危险因素的患者。应告知患者严重心血管事件的症状以及发生时应采取的措施。
血栓形成
在接受 Cibinqo 治疗的患者中报告了深静脉血栓形成 (DVT) 和肺栓塞 (PE)。在接受用于治疗炎症的 JAK 抑制剂的患者中报告了血栓形成,包括 PE、DVT 和动脉血栓形成。许多这些不良反应是严重的,有些导致死亡。与 TNF 阻滞剂相比,在 50 岁及以上且至少有一个心血管危险因素且使用另一种 JAK 抑制剂治疗的 RA 患者中,观察到更高的总体血栓形成、DVT 和 PE 发生率。Cibinqo 未被批准用于 RA 患者。
在血栓形成风险可能增加的患者中避免使用 Cibinqo。如果出现血栓形成的症状,请停止使用 Cibinqo 并对患者进行适当的治疗。
禁忌症
在治疗的前 3 个月内,除低剂量阿司匹林(每天≤81 mg)外,Cibinqo 禁用于接受抗血小板治疗的患者。
实验室异常
血液学异常: Cibinqo 治疗与血小板减少症和淋巴细胞减少症的发生率增加有关。在 Cibinqo 启动之前,执行全血细胞计数 (CBC)。建议在开始后 4 周和 Cibinqo 剂量增加后 4 周进行 CBC 评估。某些实验室异常需要停止 Cibinqo 治疗。
血脂升高:在接受 Cibinqo 治疗的患者中报告了血脂参数的剂量依赖性增加。Cibinqo 治疗开始后约 4 周应评估血脂参数,此后应根据高脂血症临床指南对患者进行管理。这些脂质参数升高对心血管发病率和死亡率的影响尚未确定。
免疫接种
在开始 Cibinqo 之前,按照当前免疫指南的建议完成所有适合年龄的疫苗接种,包括预防性带状疱疹疫苗接种。避免在 Cibinqo 治疗之前、期间和之后立即接种活疫苗。
肾功能不全
避免用于患有严重肾功能不全或终末期
肾病的患者,包括接受肾脏替代治疗的患者。
肝功能损害
避免在严重肝功能不全的患者中使用。
不良反应
接受 100 mg 和 200 mg 的受试者最常见的不良反应 (≥1%) 包括:鼻咽炎、恶心、头痛、单纯疱疹、血肌酐磷酸激酶升高、头晕、尿路感染、疲劳、痤疮、呕吐、口咽痛、流感、肠胃炎。
接受 100 mg 或 200 mg 的受试者最常见的不良反应 (≥1%) 还包括:脓疱病、高血压、接触性皮炎、上腹痛、腹部不适、带状疱疹和血小板减少症。
怀孕期间使用
Cibinqo 临床试验中报告的妊娠的现有数据不足以确定与药物相关的重大出生缺陷、流产或其他不良母体或胎儿结局的风险。忠告有生殖潜力的女性 Cibinqo 可能会损害生育能力。
将有一个妊娠暴露登记处,监测怀孕期间暴露于 Cibinqo 的妇女的妊娠结果。鼓励接触 Cibinqo 的孕妇和医疗保健提供者致电 1-877-311-3770。
哺乳期
建议女性在使用 Cibinqo 治疗期间和最后一次给药后一天不要进行母乳喂养。
适应症
Cibinqo 适用于治疗患有难治性、中度至重度特应性皮炎的成人,其疾病无法通过其他全身性药物产品(包括生物制剂)得到充分控制,或者不建议使用这些疗法。
使用限制:不建议将 Cibinqo 与其他 JAK 抑制剂、生物免疫调节剂或其他免疫抑制剂联合使用。
关于 Cibinqo ® (abrocitinib)
Cibinqo 是一种选择性抑制 Janus 激酶 (JAK) 1 的口服小分子。抑制 JAK1 被认为可调节参与 AD 病理生理学的多种细胞因子,包括白细胞介素 IL-4、IL-13、IL-31、IL-22 和胸腺基质淋巴细胞生成素 (TSLP)。
除了在美国获得监管部门批准外,Cibinqo 还在欧盟、英国、日本、韩国、阿拉伯联合酋长国、挪威、冰岛和新加坡获得了上市许可。
关于特应性皮炎
AD是一种以皮肤炎症和皮肤屏障缺陷为特征的慢性皮肤病。i,ii大多数人都知道 AD 是一种皮肤病。但许多人没有意识到它可能部分是由皮肤下的异常免疫反应引起的。这种失调的免疫反应被认为会导致皮肤内的炎症和表面的 AD 迹象。AD 病变的特征是红斑(红色/粉红色或变色的皮肤斑块,取决于正常的皮肤颜色)、瘙痒、苔藓化(厚/皮革状皮肤)、硬结(硬化)/丘疹(丘疹的形成)和渗出/结痂。一、二
AD 是最常见的炎症性皮肤病之一,在美国影响大约 5-10% 的成年人iii,iv大约三分之一的 AD 成年人患有中度至重度疾病。五,六
关于辉瑞炎症与免疫学
在辉瑞炎症与免疫学,我们努力实现突破,使患有自身免疫性和慢性炎症性疾病的人免于日常痛苦,这些疾病可能使人衰弱、毁容和痛苦,极大地影响他们的能力。以风湿病学、胃肠病学和医学皮肤病学中的免疫炎症为重点,我们目前批准的药物和研究分子组合涵盖了从局部到小分子、生物制剂和生物
仿制药的多种作用和递送机制。许多免疫疾病的根本原因是免疫炎症,这需要专门设计的药物。我们差异化的研发方法造就了业内最广泛的产品线之一,我们有目的地将分子与我们认为可以发挥最大作用的疾病相匹配。基于我们数十年的承诺和开创性的科学,我们继续提高对患有免疫炎症性疾病的患者的护理标准,并与患者、护理人员和更广泛的医疗保健社区携手合作,为许多人提供医疗保健解决方案管理慢性炎症性疾病的挑战,让患者过上最好的生活。

