【资讯导读】Apreude (cabotegravir) 是一种长效可注射整合酶链转移抑制剂 (INSTI),适用于暴露前预防 (PrEP),以降低性获得性 HIV-1 感染的风险。
公司: ViiV Healthcare
批准日期: 2021 年 12 月 20 日
治疗:暴露前预防
Apreude (cabotegravir) 是一种长效可注射整合酶链转移抑制剂 (INSTI),适用于暴露前预防 (PrEP),以降低性获得性 HIV-1 感染的风险。
葛兰素史克 (GSK) 控股、辉瑞公司 (Pfizer) 和盐野义有限公司 (Shionogi) 为股东的全球专业 HIV 公司 ViiV Healthcare 今天宣布,美国食品和药物管理局 (FDA) 批准了Apreude,这是第一个也是唯一一个用于降低性获得 HIV-1 风险的长效注射暴露前预防 (PrEP) 选择。这种长效注射剂被批准用于体重至少 35 公斤的成年人和青少年,他们有性行为感染 HIV 的风险,并且在开始前 HIV-1 检测呈阴性。该药物在男男性行为者以及女性和跨性别女性中进行了研究,她们在性行为中感染艾滋病毒的风险增加。
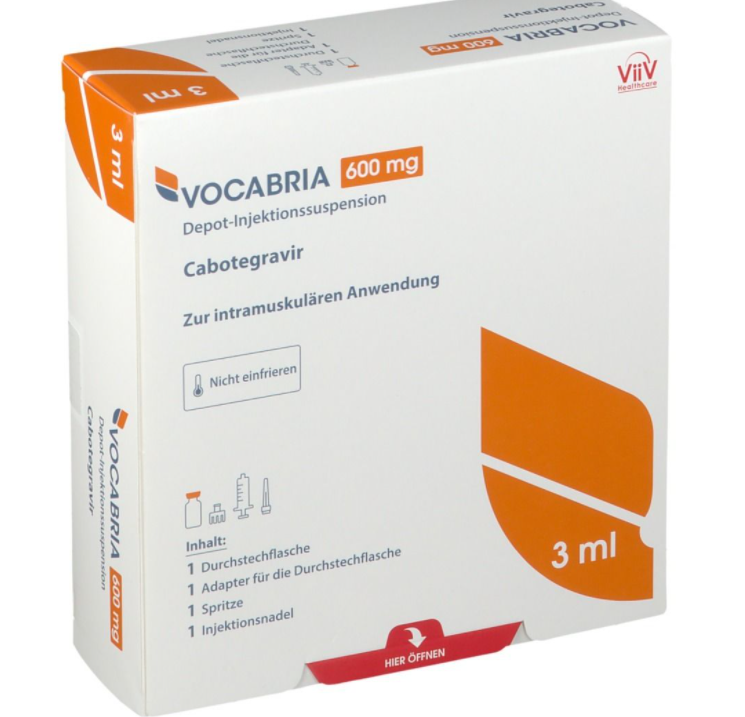
用于 PrEP 的长效 Cabotegravir 以注射形式提供,每年注射次数少至 6 次,开始时连续两个月注射一次 600 毫克(3 毫升),间隔一个月。第二次初始注射后,推荐的持续注射剂量是每两个月注射一次 600 毫克(3 毫升)。Vocabria(cabotegravir 口服片剂)可在开始第一次注射前给药约一个月,以评估药物的耐受性。
ViiV Healthcare 首席执行官黛博拉·沃特豪斯 (Deborah Waterhouse) 表示: “容易感染 HIV 的人,尤其是那些在美国受到严重影响的黑人和拉丁裔社区的人,可能需要每日口服药以外的选择。这就是为什么 ViiV Healthcare 感到自豪的是,Apreude在迄今为止最多样化和最全面的 HIV 预防试验项目之一中进行了研究,其中还包括一些曾经参加过 HIV 预防的最大数量的跨性别女性和男男性行为者审判。使用Apreude,人们每年只需注射 6 次即可降低感染 HIV 的风险。今天的批准是 ViiV Healthcare 致力于开发为消费者提供不同选择的长效药物的最新例证。”
美国 FDA 的批准是基于两项国际 IIb/III 期多中心、随机、双盲、活性对照试验 HPTN 083 和 HPTN 084 的结果,该试验评估了卡博特韦长效 PrEP 在 HIV-与男性发生性关系的阴性男性、跨性别女性和顺性别女性,她们通过性行为感染艾滋病毒的风险增加。在这些试验中,共有来自 13 个国家的 7,700 多名参与者,在证明卡博特拉韦长效 PrEP 优于每日口服恩曲他滨/恩曲他滨/富马酸
替诺福韦二吡呋酯 (TDF/FTC) 片剂在预防研究参与者感染 HIV 方面的作用。
在至少 1% 接受卡博特韦长效 PrEP 的临床试验参与者中观察到的最常见不良反应(所有级别)是注射部位反应、腹泻、头痛、发热、疲劳、睡眠障碍、恶心、头晕、胀气、腹痛、呕吐、肌痛、皮疹、食欲减退、嗜睡、背痛和上呼吸道感染。不良事件导致 HPTN 083 中 6% 的参与者和 HPTN 084 中 1% 的参与者停药。
在 HPTN 083 中,美国的参与者包括黑人/非洲裔美国人和拉丁裔男性社区和男男性行为者和跨性别女性社区,他们受艾滋病毒流行的影响不成比例,并且在新的艾滋病毒诊断中所占的比例最大。在 HPTN 084 中,所有参与者都是来自撒哈拉以南非洲的顺性别女性。该地区的妇女承受着不成比例的艾滋病毒流行负担,感染艾滋病毒的可能性可能是男性的两倍。
华盛顿健康研究所研究主任、医学博士 Richard Elion 说:“我们拥有通过实施有效的抗逆转录病毒治疗和艾滋病毒预防来结束艾滋病毒流行的工具。PrEP 在保护人们免于感染 HIV 方面发挥了至关重要的作用。随着用于 PrEP 的长效 cabotegravir 每两个月注射一次以预防 HIV,人们现在除了日常用药之外还有一个重要的新选择。这种长效药物为预防提供了更多选择,现在提供者和患者将通过选择和选择最适合每个人的方法的能力获得授权。”
艾滋病毒仍然是全球公共卫生危机,估计全世界有 3800 万人感染艾滋病毒,每年有 170 万新病例。PrEP 是减少 HIV 新发病例的有效工具,除了成功的 HIV 抗逆转录病毒治疗外,还将有助于结束 HIV 流行。然而,目前在美国可以从 PrEP 中受益的人中,只有不到 25% 正在服用它。尽管每日口服 PrEP 广泛可用,但它可能会受到不一致的依从性以及导致关键人群未充分利用的结构和文化障碍的限制。
TruEvolution 执行董事兼首席执行官加布里埃尔·马尔多纳多 (Gabriel Maldonado) 说: “许多易感染艾滋病毒的人生活复杂,每天服用预防艾滋病毒的药丸成为一种负担。这可能包括耻辱感、对药物意外泄露的恐惧,以及日常生活中的一般并发症。总之,这些问题可能导致 PrEP 使用率低和 HIV 流行病的扩大。我们的社区迫切需要额外的 HIV 预防选择来满足他们不断变化的需求,而用于 PrEP 的长效 cabotegravir 代表了一个令人兴奋的新选择,可以帮助他们降低感染 HIV 的风险。”
欢跃医疗保健将开始出货Apretude早在2022年欢跃医疗集团发起提交给其他监管机构在美国批发商和分销商的专业。Apreude尚未在美国以外的任何地方获得批准或许可用于 HIV 预防。
关于Apretude(cabotegravir 缓释注射悬浮液)
Apretude是第一个也是唯一一个长效注射暴露前预防 (PrEP) 选择,在减少 HIV 感染方面被证明优于每日口服 FTC/TDF。它适用于有性行为感染 HIV 风险、体重至少 35 公斤且在开始前 HIV-1 检测呈阴性的成人和青少年的 HIV PrEP。在相隔一个月的两次初始注射和可选的口服导入以评估耐受性后,医疗保健提供者每两个月在臀部进行一次 600 mg (3-ml) cabotegravir 肌内 (IM) 注射给药。
Apreude是一种整合酶链转移抑制剂 (INSTI)。INSTI 与 cabotegravir 缓释注射悬浮液一样,通过阻止病毒 DNA 整合到人类免疫细胞 (T 细胞) 的遗传物质中来抑制 HIV 复制。这一步在 HIV 复制周期中是必不可少的,也是造成慢性疾病的原因。
关于 HPTN 083 (NCT02720094)
HPTN 083 试验是一项 IIb/III 期双盲非劣效性试验,旨在评估与每日口服 FTC/TDF 片剂(200 mg/300毫克)。该试验包括预先指定的测试长效 cabotegravir 优于 TDF/FTC 的能力。试验设计包括口服导入阶段,以评估在肌肉注射前对 cabotegravir 的耐受性。每个参与者将接受最多三年的盲试验药物治疗。该试验于 2016 年 11 月开始招募。 HPTN 083 在 4,566 名 HIV 阴性男男性行为者和跨性别女性中进行,这些女性有证据表明其行为会使他们面临性感染 HIV-1 的高风险.
发现长效 cabotegravir 在预防试验人群中的 HIV 感染方面优于每日口服 FTC/TDF。在至少 1% 接受长效 cabotegravir 的受试者中观察到的最常见不良反应(所有级别)是注射部位反应、腹泻、头痛、发热、疲劳、睡眠障碍、恶心、头晕、胀气和腹痛。
HPTN 084 试验是一项 IIb/III 期双盲优势试验,旨在评估与每日口服 FTC/TDF 片剂相比,每八周注射一次长效注射用卡博特拉韦预防 HIV 的安全性和有效性(200 毫克/300 毫克)在 3,224 名感染 HIV 风险增加的顺性别女性中。试验设计包括口服导入阶段,以评估肌肉注射前对卡博特韦的耐受性。HPTN 084 于 2017 年 11 月开放注册,目前正在博茨瓦纳、肯尼亚、马拉维、南非、埃斯瓦蒂尼、乌干达和津巴布韦的研究中心进行。
发现长效 cabotegravir 在预防试验人群中的 HIV 感染方面优于每日口服 FTC/TDF。在至少 1% 接受长效 cabotegravir 的受试者中观察到的最常见不良反应(所有级别)是注射部位反应、腹泻、头痛、疲劳、睡眠障碍、恶心、头晕、腹痛、呕吐、肌痛和皮疹。
Apreude(cabotegravir 200 mg/mL 缓释注射混悬液)的适应症和重要安全信息
Apreude 是一种 HIV-1 整合酶链转移抑制剂 (INSTI),适用于体重至少 35 公斤的高危成人和青少年进行暴露前预防 (PrEP),以降低性获得 HIV-1 感染的风险。在为 HIV-1 PrEP 开始使用 Apretude(有或没有口服 cabotegravir 的口服导入)之前,个人必须有一个阴性 HIV-1 检测。Apreude 是由医疗保健专业人员每 2 个月一次在臀部肌肉中单次 600 毫克(3 毫升)卡博特韦的肌肉注射(IM)注射给药。
警告:在未确诊的 HIV-1 感染中使用 APRETUDE 的 HIV-1 暴露前预防 (PrEP) 存在耐药风险
有关完整的黑框警告,请参阅完整的处方信息。
在开始使用 Apreude 或口服 cabotegravir 之前,必须对个人进行 HIV-1 感染测试,并且在随后每次注射 Apreude 时,都必须使用 FDA 批准或批准的用于诊断急性或原发性 HIV-1 感染的测试。未确诊的 HIV-1 感染者使用 Apretude for HIV-1 PrEP 已鉴定出抗药性 HIV-1 变体。除非确认阴性感染状态,否则不要为 HIV-1 PrEP 启动 Apreude。在接受 Apreude for PrEP 时感染 HIV-1 的个人必须过渡到完整的 HIV-1 治疗方案。
禁忌症
未知或阳性 HIV-1 状态。
以前对cabotegravir 的超敏反应。
与可能发生卡博特韦血浆浓度显着降低的药物共同给药。
警告和注意事项
使用 APRETUDE for HIV-1 PrEP 降低 HIV-1 感染风险,作为综合管理的一部分,降低 HIV-1 感染风险。
如果个人在服用 Apreude 之前或期间或在停止 Apreude 之后感染 HIV-1,则存在对 Apreude 产生抗药性的潜在风险。在每次注射前重新评估 HIV-1 感染和检测的风险,以确认 HIV-1 阴性状态。
cabotegravir 的残留浓度可能会在个体的体循环中保留长达 12 个月或更长时间。
已经报道了与其他整合酶抑制剂相关的超敏反应。如果出现超敏反应的体征或症状,请立即停止 Apreude。
据报道,接受cabotegravir 的患者有肝毒性。应考虑临床和实验室监测。如果怀疑有肝毒性,请停止 Apreude。
据报道,Apreude 会导致抑郁症。建议对抑郁症状进行及时评估。
不良反应
在至少 1% 接受 Apreude 的受试者中观察到的最常见不良反应(所有级别)是注射部位反应、腹泻、头痛、发热、疲劳、睡眠障碍、恶心、头晕、胀气、腹痛、呕吐、肌痛、皮疹、食欲下降、嗜睡、背痛和上呼吸道感染。
药物相互作用
有关与 Apreude 的重要药物相互作用,请参阅完整的处方信息。
诱导尿苷二磷酸葡萄糖醛酸转移酶 (UGT1A1) 的药物可能会显着降低卡博特韦的血浆浓度。
在特定人群中使用
哺乳期:评估在母乳喂养时使用 Apreude 对婴儿的益处-风险,因为在停药后长达 12 个月或更长时间内可能出现不良反应和体循环中的残留浓度。
儿科:不建议体重低于 35 公斤的人使用。
请参阅完整的处方信息。
商标归 ViiV Healthcare 集团公司所有或获得许可。
关于 ViiV Healthcare
ViiV Healthcare 是一家由葛兰素史克(伦敦证券交易所/纽约证券交易所代码:GSK)和辉瑞公司(纽约证券交易所代码:PFE)于 2009 年 11 月成立的全球专业 HIV 公司,致力于为 HIV 感染者和处于感染艾滋病毒的风险。Shionogi 于 2012 年 10 月作为股东加入。该公司的目标是比以往任何公司都更深入、更广泛地关注艾滋病毒和艾滋病,并采取新方法提供有效和创新的艾滋病毒治疗和预防药物,并提供支持受艾滋病毒影响的社区。
关于 GSK
GSK 是一家以科学为主导的全球医疗保健公司。
关于前瞻性陈述的
警告声明GSK 告诫投资者,GSK 做出的任何前瞻性陈述或预测,包括本公告中的那些,都存在风险和不确定性,可能导致实际结果与预期结果存在重大差异。这些因素包括但不限于公司 2020 年 20-F 表年度报告、葛兰素史克 2021 年第三季度业绩以及 COVID-19 大流行的任何影响中描述的因素。
资料来源:葛兰素史克
发布时间:2021 年 12 月

